Explorando los biosimilares: mejores resultados de salud y atención médica accesible
- Los biosimilares son los productos biológicos más asequibles sin diferencias clínicamente significativas en pureza, eficacia y seguridad con respecto a los productos biológicos de referencia.1
- Su aprobación regulatoria sigue estrictos estándares de calidad, seguridad y eficacia, como es común con otras terapias.1,3
- Al adoptar los biosimilares, el sistema de salud puede navegar hacia un futuro de atención más accesible, eficiente y asequible para los pacientes.3
Los productos biológicos, o productos biológicos, abarcan una variedad de agentes terapéuticos, como la sangre, los componentes sanguíneos, las vacunas, los alérgenos, las células, las terapias génicas y las proteínas terapéuticas recombinantes. Estos productos se derivan de organismos vivos como animales, humanos y microorganismos. Los productos biológicos se producen utilizando métodos biotecnológicos avanzados y representan avances significativos en el campo biomédico, ya que ofrecen tratamiento para afecciones médicas complejas que anteriormente no tenían opciones de tratamiento disponibles.4
De los productos biológicos a los biosimilares: desvelando nuevos horizontes
Debido a que están hechos de células vivas, los productos biológicos son más complejos estructural y funcionalmente que los medicamentos típicos de moléculas pequeñas. El desarrollo y la fabricación de productos biológicos requieren investigación biomédica de vanguardia y métodos biotecnológicos avanzados, lo que resulta en su alto costo.5 Por ejemplo, los productos biológicos representan solo el 2% de todas las recetas en los EE. UU., pero representan el 40% del gasto total en recetas.3 Esto supone una importante carga económica para los sistemas sanitarios, ya que limita los recursos y restringe el acceso a los pacientes. Más aún, en los países en desarrollo con una atención médica financiada con fondos públicos fragmentada, los pacientes a menudo no pueden permitirse la mejor opción de tratamiento disponible que se ofrece a través de los productos biológicos debido a su naturaleza costosa.6,7
La pérdida de la exclusividad de mercado para los productos biológicos ha llevado al desarrollo de biosimilares, las versiones no innovadoras del medicamento biológico de referencia, definidas por diversos organismos reguladores, como se describe en la Tabla 1.5,8 Ha dado lugar a un panorama de tratamiento más accesible y equitativo, aumentando el acceso al tratamiento y la elección de recetas para pacientes y médicos, respectivamente.7,9
Tabla 1: Definición de biosimilares por parte de las principales autoridades reguladoras de todo el mundo8
| Lineamientos Regulatorios | Definición |
| Agencia Europea de Medicamentos (EMA) | Un medicamento biológico similar a otro medicamento biológico que ya ha sido autorizado para su uso |
| Organización Mundial de la Salud (OMS) | Un producto bioterapéutico que es similar en términos de calidad, seguridad y eficacia a un producto bioterapéutico de referencia ya autorizado |
| Administración de Alimentos y Medicamentos de los Estados Unidos (FDA de EE. UU.) | Un producto biológico que es muy similar al producto de referencia a pesar de las pequeñas diferencias en los componentes clínicamente inactivos y de que no hay diferencias clínicamente significativas entre el producto biológico y el producto de referencia en términos de seguridad, pureza y potencia del producto |
| Agencia de Productos Farmacéuticos y Dispositivos Médicos (PMDA) | Un producto farmacéutico biotecnológico desarrollado por una empresa diferente, que es comparable con un producto derivado de la biotecnología aprobado |
Los países de ingresos bajos y medianos soportan una alta carga de enfermedades no transmisibles, así como disparidades en la atención médica. Los biosimilares son importantes para abordar las disparidades en la atención médica al ampliar el acceso a medicamentos que salvan vidas.10 La Organización Mundial de la Salud reconoce la salud como un derecho humano básico y afirma que todas las personas deben tener acceso a los servicios de salud sin tener que enfrentar dificultades financieras.11 Los biosimilares son un paso en esta dirección que puede ayudar a llevar la equidad en salud a todos.
Comprender los biosimilares: las vías de desarrollo y aprobación
Los biosimilares se aprueban a través de los mismos estándares farmacéuticos de calidad, seguridad y eficacia que se aplican a otros productos biológicos. Debido a la variabilidad inherente asociada con la fabricación biofarmacéutica, los biosimilares no son la copia exacta de su producto biológico de referencia. En cambio, el programa de desarrollo de biosimilares tiene como objetivo demostrar una alta similitud en estructura, función, eficacia, seguridad e inmunogenicidad a través de un extenso análisis comparativo preclínico y clínico. Las etapas clave en el programa original de desarrollo de productos biológicos y biosimilares se describen en la Figura 1.1 Como se puede medir fácilmente, los biosimilares no se someten al programa de investigación clínica a la escala requerida para el medicamento de referencia, pero la mayor parte de los estudios tratan de establecer la similitud molecular y estructural. Los biosimilares no deben mostrar diferencias clínicamente significativas con respecto a la molécula de referencia, y cualquier variabilidad debe mantenerse dentro de límites estrictos.1
Los biosimilares aprovechan los datos de seguridad y eficacia del medicamento de referencia demostrando una seguridad y eficacia comparables en una indicación, que pueden extrapolarse a todas las demás indicaciones aprobadas del medicamento de referencia. Esto ayuda a eludir la evaluación repetitiva de múltiples niveles a través de ensayos clínicos para cada nueva indicación, lo que resulta en un programa de desarrollo más corto y rentable. Este concepto de extrapolación se basa en principios científicos y se utiliza de forma rutinaria para los productos biológicos aprobados si se someten a cambios importantes en la fabricación, sin necesidad de repetir los ensayos clínicos para todas las indicaciones.12
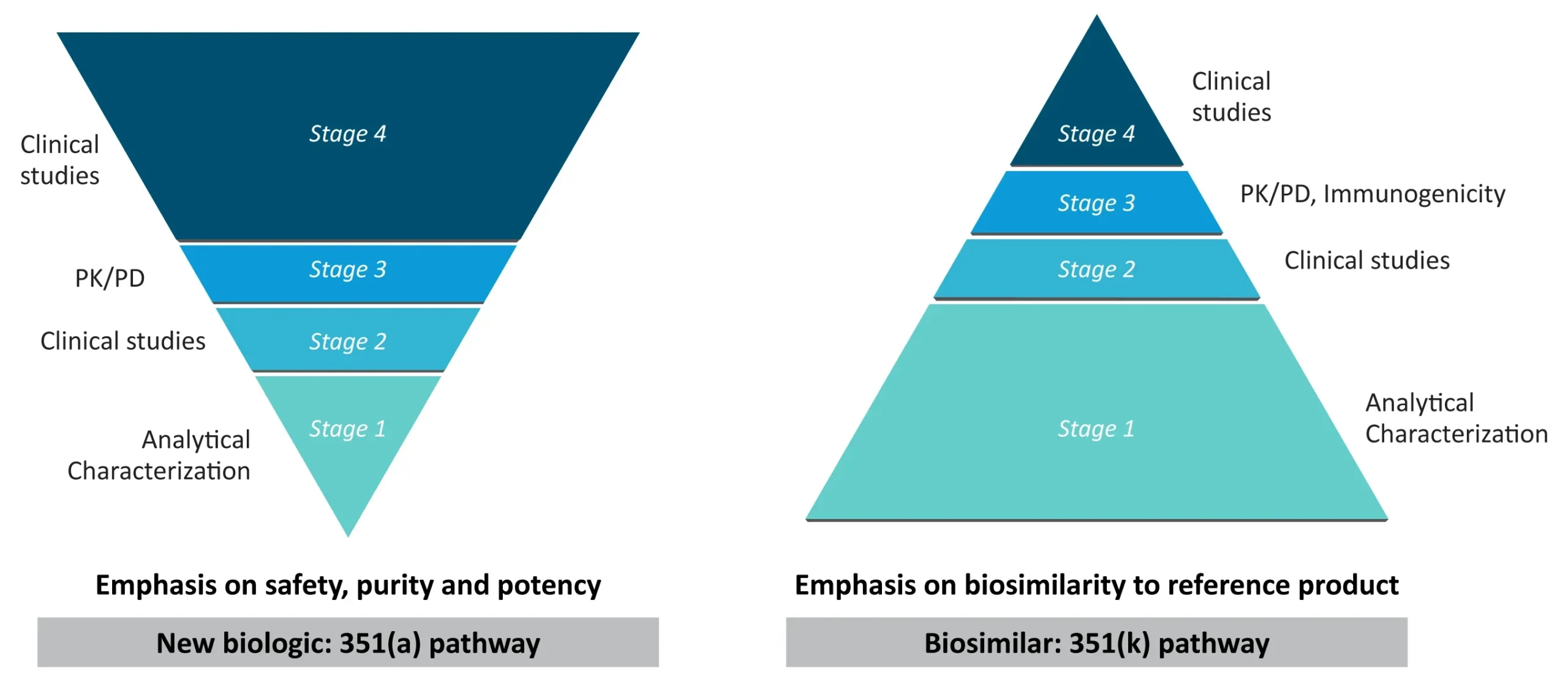
Figura 1: Comparación de las vías de desarrollo de nuevos productos biológicos y biosimilares
(La figura es solo para fines ilustrativos y es una adaptación de Sheridan et al. 2024).1
La Unión Europea fue la primera en establecer un marco regulatorio de aprobación de biosimilares y, en base a él, la Agencia Médica Europea (EMA) aprobó el primer biosimilar en 2006.12 En 2009, la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) de EE. UU. puso en marcha la vía 351(k), un proceso simplificado para la aprobación de biosimilares.1 En la actualidad, Europa lidera la aceptación de biosimilares, representando el 60% del consumo mundial de biosimilares.9 Es importante destacar que, en sus 10 años de experiencia con biosimilares, el sistema de seguimiento de la UE en lo que respecta a los problemas de seguridad no ha documentado ningún problema significativo de seguridad para los biosimilares, sin diferencias relevantes en la naturaleza, la gravedad o la frecuencia de los acontecimientos adversos.12
Uso de biosimilares para aumentar el acceso y reducir los costos
La disponibilidad de biosimilares como alternativa rentable a los productos biológicos de referencia ofrece una vía prometedora para reducir los costes sanitarios y mejorar el acceso al tratamiento. Según un informe de IQVIA, entre 2016 y 2021, se estima que el ahorro total europeo a precios de catálogo como impacto directo de la competencia de biosimilares es de unos 50.000 millones de euros.13 Se estima que el cambio al biosimilar de infliximab, un inhibidor del TNFα utilizado para el tratamiento de la artritis reumatoide, podría suponer un ahorro de entre 233 y 433 millones de euros en 5 años solo en el Reino Unido, Francia y Alemania. Esto se traduce aproximadamente en un descuento del 20-30% sobre el precio de venta actual de infliximab. Estos ahorros se pueden utilizar aún más para tratar a aproximadamente 7500 pacientes adicionales con artritis reumatoide.3 Del mismo modo, en los EE. UU., los biosimilares han supuesto un ahorro estimado de 13.000 millones de dólares desde 2015, ya que sus precios suelen ser entre un 15 y un 35 % más bajos que los del producto biológico de referencia respectivo y se espera que ahorren entre 38 y 124 mil millones de dólares entre 2021 y 2025.14 Una mayor utilización del biosimilar de rituximab recetado para el tratamiento del cáncer y la artritis reumatoide puede generar ahorros en el rango del 44 al 69% en el precio de venta del fabricante, con aproximadamente un 12% menos de gastos de bolsillo para los pacientes.3 Se informó que la competencia debido a los biosimilares redujo los costos para la Parte B de Medicare y los afiliados.10
Esta posible reducción de costes es fundamental para mejorar el acceso de los pacientes a los tratamientos biológicos.15 Esta mayor asequibilidad puede mejorar la adherencia de los pacientes, especialmente para aquellos que, de otro modo, tendrían dificultades para pagar sus medicamentos, especialmente en economías emergentes con una infraestructura de atención médica deficiente.10 Por ejemplo, los países del sudeste asiático como Malasia han experimentado caídas significativas de precios (hasta un 40%) y un aumento correspondiente en el acceso a la insulina (alrededor del 30%) desde el lanzamiento de sus biosimilares en 2011.10 La India tiene un panorama de biosimilares en auge y había reconocido su valor en la atención médica asequible mucho antes, aprobando el primer biosimilar en el año 2000 y adoptando formalmente las pautas regulatorias de biosimilares en 2012.7
Biosimilares: una batalla de percepción y utilización
Como se ha comentado anteriormente, los biosimilares no tienen diferencias clínicamente significativas en su estructura y función con respecto a los productos biológicos de referencia, y están aprobados a través de estrictos procesos regulatorios que garantizan su calidad, eficacia clínica y seguridad.12 Existe evidencia significativa de que el inicio de biosimilares o la transición de bio-originadores a biosimilares producto a un biosimilar no disminuye la eficacia del tratamiento ni aumenta la probabilidad de eventos adversos.1
A pesar del aumento de las aprobaciones regulatorias y el potencial de ahorro de costos, existen múltiples barreras que impiden la adopción de biosimilares.16 La adopción de biosimilares en la práctica clínica depende en gran medida de las políticas que promuevan su adopción, así como de la comprensión de los biosimilares por parte de los profesionales de la salud y los pacientes y de la confianza en su uso.14 La confianza de los prescriptores es crucial para que los pacientes adopten los biosimilares y disminuyan la aparición del efecto nocebo (las expectativas negativas del paciente con respecto a un tratamiento hacen que el tratamiento tenga un efecto más negativo del que tendría de otro modo).1 Una mayor comprensión y educación sobre estas alternativas es esencial para integrarlas en la práctica clínica.15
Biosimilares para mejorar la adherencia
Los informes han sugerido que el mayor costo de los productos biológicos conduce a una menor adherencia con el tiempo. Los biosimilares ofrecen una alternativa más rentable a los productos biológicos de referencia de alto coste y, por lo tanto, podrían tener un impacto positivo en la adherencia a la medicación.15 En un estudio sobre productos biológicos no administrados por médicos, los copagos más altos se asociaron con tasas más bajas de adherencia.17
Un estudio transversal a nivel nacional realizado en Francia en pacientes con enfermedad inflamatoria reumática reveló que estar informado sobre los biosimilares y una buena comprensión de la definición de biosimilares eran características asociadas con una mejor adherencia a los biosimilares.18 Esto pone de relieve el potencial de los biosimilares no solo para mejorar la asequibilidad, sino también para promover la adherencia terapéutica sostenida.
Conclusión
En el dinámico sector de la salud, los biosimilares destacan por hacer que los tratamientos críticos sean más accesibles y económicamente asumibles.1 Los marcos regulatorios han simplificado su entrada, manteniendo altos estándares de similitud y efectividad, preservando así la integridad terapéutica.12 Europa lidera la aprobación y el consumo de biosimilares (casi el 60% del consumo mundial), marcando un camino que otros pueden seguir para reducir los costes sanitarios y democratizar el acceso a los medicamentos esenciales.9 A medida que los países de ingresos bajos y medianos avanzan lentamente hacia las aprobaciones regulatorias para los biosimilares, también deben centrarse en políticas que mejoren su aceptación. Por último, el esfuerzo no solo debe consistir en reducir costes, sino también en influir en los resultados de los pacientes y mejorar la adherencia.
“La esencia de la equidad en salud global es la idea de que algo tan precioso como la salud puede ser visto como un derecho” – Paul Farmer, antropólogo y médico estadounidense.






